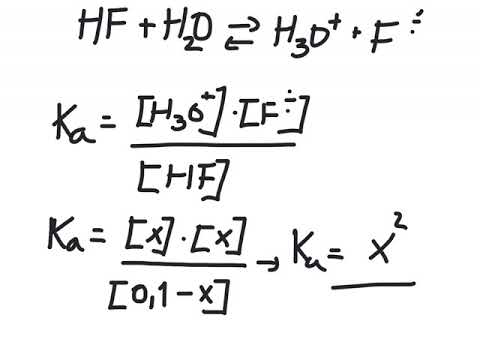
I følge Bronsted-Lowry-teorien om syrer og baser, gir et syremolekyl et enkelt proton til et vannmolekyl, og skaper et H3O + -ion og et negativt ladet ion som kalles "konjugatbase." Mens syrer som svovelsyre (H2SO4), kullsyre (H2CO3) og fosforsyre (H3PO4) har flere protoner (dvs. hydrogenatomer) å donere, teller hvert proton som er gitt som et separat syrekonjugat-basepar. For eksempel har fosforsyre bare en konjugatbase: dihydrogenfosfat (H2PO4-). I mellomtiden er hydrogenfosfat (HPO4 2-) konjugatbasen av dihydrogenfosfat og fosfat (PO4 3-) er konjugatbasen av hydrogenfosfat.
Telle det totale antall hydrogenatomer i syren.
Telle syremolekylenes totale antall ladninger (ladningen til et ionisk molekyl er uttrykt som et heltall etterfulgt av et positivt eller negativt tegn). Derfor ville et molekyl med hydrogenfosfat (HPO4 2-) ha en ladning på "-2", mens et molekyl med fosforsyre (H3PO4) vil ha en ladning på "0."
Trekk "1" fra det totale antall hydrogenatomer. For eksempel, hvis svovelsyre har to hydrogener, vil dens konjugatbase bare ha ett hydrogenatom.
Legg til "-1" til molekylenes totale ladning. Så hvis surt hydrogensulfat har en ladning på "-1", vil dens konjugatbase ha en ladning på "-2."