Innhold
Kovalente bindinger og hydrogenbindinger er primære intermolekylære krefter. Kovalente bindinger kan oppstå mellom de fleste elementer på det periodiske systemet. Hydrogenbindinger er en spesiell binding mellom et hydrogenatom og et oksygen-, nitrogen- eller fluoratom.
Valence
••• Jupiterimages / Photos.com / Getty ImagesKraften til et element til å kombinere med andre elementer er representert av et tildelt nummer kalt valensen. For ioner er valensen lik den elektriske ladningen. For eksempel er valensen for klor 3p5, så den vil lett få ett elektron, og det resulterende ionet er Cl-.
Octet-regelen


Octetregelen er basert på ideen om at edelgasskonfigurasjonen (s2p6) er den mest gunstige og kan oppnås ved dannelse av elektronpar-bindinger med andre atomer.
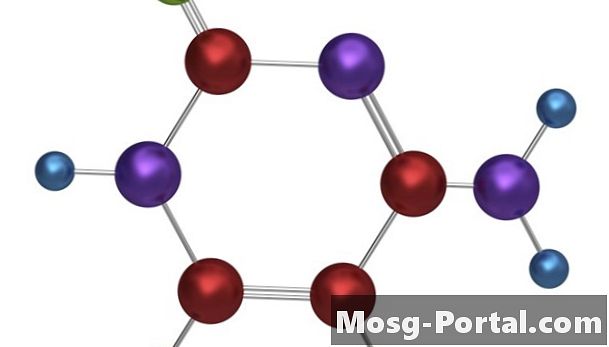
Kovalente bindinger
••• Tempusfugit / iStock / Getty ImagesKovalente bindinger dannes når to eller flere atomer deler elektroner for å fylle deres ytterste elektronskjell.
Hydrogenobligasjoner


En hydrogenbinding oppstår når den delvis positive ladningen av et hydrogenatom binder seg til et elektronegativt molekyl, vanligvis oksygen, nitrogen eller fluor.
Kovalente v. Hydrogenbindinger

Både kovalente og hydrogenbindinger er former for intermolekylære krefter. Kovalente bindinger kan forekomme med de fleste elementer på det periodiske systemet, mens hydrogenbindinger vanligvis forekommer mellom et hydrogenatom og et oksygen-, nitrogen- eller fluormolekyl. Hydrogenbindinger er også bare 1/10 så sterke som en kovalent binding.