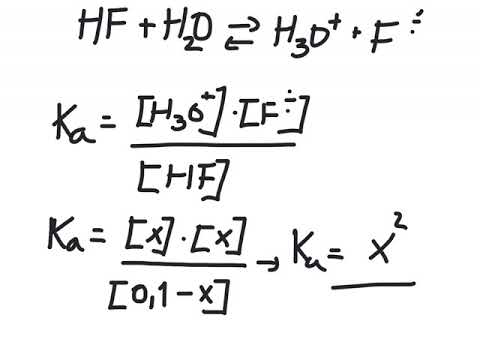
Innhold
Hver syre har en karakteristisk dissosiasjonskonstant (Ken), som er et mål på dens evne til å donere hydrogenioner i løsning. Med andre ord, Ken gir en måte å måle styrken til en syre på. Større verdier betyr sterkere syrer. PH (kraft av hydrogen) til en løsning er et mål på konsentrasjonen av hydrogenioner og er også et mål på surhet, men den er ikke den samme som Ken. Det er imidlertid et forhold mellom de to, og du kan beregne Ken for en syre hvis du vet konsentrasjonen av syre og pH i løsningen.
Dissociation Constant Ka
En forbindelse er sur hvis den kan donere hydrogenioner til en vandig løsning, noe som tilsvarer at forbindelsen er i stand til å skape hydroniumioner (H30+). Den generelle ligningen som beskriver hva som skjer med en syre (HA) i løsning er:
HA + H20 <--> H30+ + A-, hvor en- er den konjugerte basen.
Noen syrer er sterke og dissosierer fullstendig, mens andre er svake og bare delvis dissosierer. Du kan måle styrken til en syre ved dens dissosiasjonskonstant Ken, som er et forhold dannet ved å dele konsentrasjonen av produkter med konsentrasjonen av reaktanter:
Ken = /
Alle reaksjonene skjer i vann, så det slettes vanligvis fra ligningen.
Avlede Ka fra pH
PH i en vandig syreoppløsning er et mål på konsentrasjonen av fritt hydrogen (eller hydronium) -ioner som den inneholder: pH = -log eller pH = -log. Den siste ligningen kan skrives om:
= 10Ph
Det du kjenner den molære konsentrasjonen av en syreoppløsning og kan måle dens pH, mens ekvivalensen ovenfor lar deg beregne den relative konsentrasjonen av syre til konjugatbase og utlede dissosiasjonskonstanten Ken. For å gjøre dette hjelper det å sette opp en tabell som avgrenser Jegstartkonsentrasjoner av reaktanter og produkter, Changer i konsentrasjoner og konsentrasjonene kl Equilibrium. Dette er et ICE-bord. I stedet for å sette opp en på en generell måte, er det mer lærerikt å illustrere fremgangsmåten med et spesifikt eksempel.
Dissosiasjonskonstant for eddiksyre
Eddiksyre, syren som gir eddik den sure smaken, er en svak syre som dissosierer til acetat og hydroniumioner i oppløsning.
CH3CO2H + H2O <--> CH3CO2− + H3O+
Typisk husholdningseddik er en 0,9 M løsning med en pH på 2,4. Ved hjelp av dataene er det mulig å beregne dissosiasjonskonstanten:
Eddiksyre (CH3CO2)H) Hydronium ion (H3O+) Acetate Ions (CH3CO2-)
Innledende 0,9 M 0 0
Endre -x M + x M + x M
Likevekt (0,9 - x) M x M x M
Dissosiasjonskonstanten Ken er / .
Ken = x2/(0,9 - x)
Som nevnt ovenfor, = 10Ph. Siden x = og du vet pH i løsningen, kan du skrive x = 10-2.4. Det er nå mulig å finne en numerisk verdi for Ka.
Ka = (10-2.4)2 /(0.9 - 10-2.4) = 1,8 x 10-5.