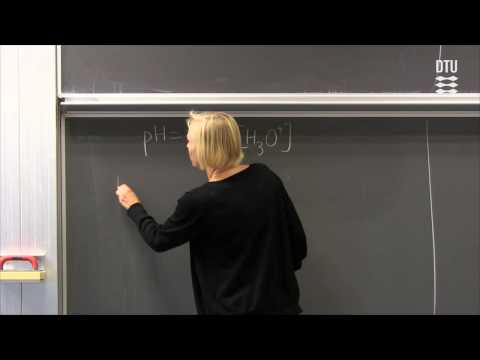
Når du beskriver hvor sur eller basisk en løsning er, beskriver du konsentrasjonen av to av ionene. Den første, hydronium (H3O +), dannes når et hydrogenion fra vann eller et løst stoff fester seg til et vannmolekyl. Det andre, hydroksyd (OH-), dannes når et oppløst stoff dissosierer til hydroksid eller når et molekyl med vann mister et hydrogenion. En oppløsnings-pH beskriver både hydronium og hydroksydkonsentrasjonen ved bruk av en logaritmisk skala.
Multipliser løsningene pH med -1. Tenk deg for eksempel en løsning med en pH-verdi på 3,3--3,3 x -1 = -3,3.
Hev 10 til kraften i resultatet - 10 ^ -3,3 = 0,00050118723, eller omtrent 5 x 10 ^ -4. Dette er konsentrasjonen av hydroniumioner, målt i mol per liter.
Trekk fra 14 fra pH - 3,3 - 14 = -10,7.
Hev 10 til resultatet - 10 ^ -10,7 = 1,995 x 10 ^ -11, eller omtrent 2,0 x 10 ^ -11. Dette er hydroksydkonsentrasjonen i oppløsningen, målt i mol per liter.