Innhold
- Termodynamikkens vitenskap
- Hva er varmekapasitet?
- Varmekapasitet: enkle beregninger
- Hva er forholdet mellom cp og cv γ?
- Cp og Cv of Air
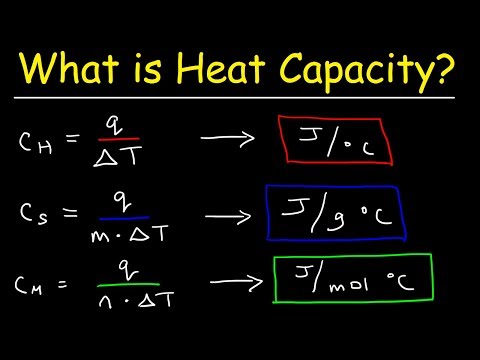
Varmekapasitet er et begrep i fysikk som beskriver hvor mye varme som må tilsettes et stoff for å heve temperaturen med 1 grad Celsius. Dette er relatert til, men forskjellig fra, spesifikk varme, som er mengden varme som trengs for å øke nøyaktig 1 gram (eller en annen fast masseenhet) av et stoff med 1 grad Celsius. Å avlede stoffets varmekapasitet C fra den spesifikke varmen S handler om å multiplisere med mengden av stoffet som er til stede og sørge for at du bruker de samme masseenhetene i hele problemet. Varmekapasitet er helt klart en indeks over en gjenstandes evne til å motstå å bli varmet av tilsetning av varmeenergi.
Materiale kan eksistere som et fast stoff, en væske eller en gass. Ved gasser kan varmekapasiteten avhenge av både omgivelsestrykk og omgivelsestemperatur. Forskere vil ofte vite varmekapasiteten til en gass ved konstant trykk, mens andre variabler som temperatur får lov til å endre seg; dette er kjent som Cp. Tilsvarende kan det være nyttig å bestemme en gassvarmekapasitet ved et konstant volum, eller Cv. Forholdet mellom Cp til Cv tilbyr viktig informasjon om de termodynamiske egenskapene til en gass.
Termodynamikkens vitenskap
Før du går i gang med en diskusjon om varmekapasitet og spesifikk varme, er det nyttig å først forstå det grunnleggende om varmeoverføring i fysikk, og begrepet varme generelt, og gjøre deg kjent med noen av de grunnleggende ligningene for fagområdet.
termodynamikk er en gren av fysikk som arbeider med et systems arbeid og energi. Arbeid, energi og varme har alle de samme enhetene i fysikk til tross for at de har forskjellige betydninger og anvendelser. SI (standard internasjonal) varmeenhet er joule. Arbeid er definert som kraft multiplisert med avstand, så med et øye på SI-enhetene for hver av disse mengdene, er en joule det samme som en Newton-meter. Andre enheter du sannsynligvis vil møte for varme inkluderer kalori (cal), britiske termiske enheter (btu) og erg.(Legg merke til at "kaloriene" du ser på etikettene for maternæring faktisk er kilokalorier, "kilo-" er det greske prefikset som betyr "tusen". Når du ser at en 12-unns brus inneholder 120 " kalorier, "dette er faktisk lik 120.000 kalorier i formelle fysiske termer.)
Gasser oppfører seg annerledes enn væsker og faste stoffer. Derfor har fysikere i verden av aerodynamikk og beslektede fagdisipliner, som naturlig nok er veldig opptatt av atferden til luft og andre gasser i arbeidet med høyhastighetsmotorer og flyvemaskiner, spesielle bekymringer for varmekapasiteten og andre kvantifiserbare fysiske parametere relatert. å ha betydning i denne tilstanden. Et eksempel er entalpi, som er et mål på den indre varmen til et lukket system. Det er summen av energien i systemet pluss produktet av dets trykk og volum:
H = E + PV
Mer spesifikt er endringen i entalpi relatert til endringen i gassvolum av forholdet:
∆H = E + P∆V
Det greske symbolet ∆, eller delta, betyr "endring" eller "forskjell" etter konvensjon i fysikk og matematikk. I tillegg kan du bekrefte at volumet av trykketider gir arbeidsenheter; trykk måles i newton / m2mens volumet kan uttrykkes i m3.
Trykket og volumet til en gass er også relatert av ligningen:
P∆V = R∆T
hvor T er temperaturen, og R er en konstant som har en annen verdi for hver gass.
Du trenger ikke å forplikte disse ligningene til minnet, men de vil bli besøkt senere i diskusjonen om Cp og Cv.
Hva er varmekapasitet?
Som nevnt er varmekapasitet og spesifikk varme relaterte mengder. Den første oppstår faktisk fra den andre. Spesifikk varme er en tilstandsvariabel, noe som betyr at den kun forholder seg til et stoffs indre egenskaper og ikke til hvor mye av det som er til stede. Det uttrykkes derfor som varme per masseenhet. Varmekapasitet er derimot avhengig av hvor mye av det aktuelle stoffet som gjennomgår en varmeoverføring, og det er ikke en tilstandsvariabel.
All materie har en temperatur assosiert med det. Dette er kanskje ikke det første som kommer opp i tankene når du legger merke til et objekt ("Jeg lurer på hvor varm den boken er?"), Men underveis har du kanskje lært at forskere aldri har klart å oppnå en temperatur på absolutt null under alle forhold, selv om de har kommet pinefullt nær. (Årsaken til at folk tar sikte på å gjøre noe slikt har å gjøre med ekstremt kalde materialers ekstreme høye ledningsevneegenskaper; bare tenk på verdien av en fysisk elektrisk leder uten praktisk talt ingen motstand.) Temperatur er et mål på molekylers bevegelse. . I faste materialer er stoff anordnet i et gitter eller rutenett, og molekyler er ikke frie til å bevege seg. I en væske er molekyler mer bevegelige, men de er fremdeles begrenset i stor grad. I en gass kan molekyler bevege seg veldig fritt. Bare husk at lav temperatur innebærer liten molekylær bevegelse.
Når du vil flytte et objekt, inkludert deg selv, fra et fysisk sted til et annet, må du bruke energi - eller alternativt gjøre arbeid - for å gjøre det. Du må reise deg og gå over et rom, eller du må trykke på gasspedalen til en bil for å tvinge drivstoff gjennom motoren og tvinge bilen til å bevege seg. Tilsvarende, på mikronivå, kreves det en tilførsel av energi til et system for å få molekylene til å bevege seg. Hvis denne tilførselen av energi er tilstrekkelig til å forårsake en økning i molekylær bevegelse, innebærer dette nødvendigvis at stoffets temperatur også øker, basert på diskusjonen ovenfor.
Ulike vanlige stoffer har vidt varierende verdier av spesifikk varme. Blant metaller, for eksempel, sjekker gull inn ved 0,129 J / g ° C, noe som betyr at 0,129 Joule varme er tilstrekkelig til å heve temperaturen på 1 gram gull med 1 grad Celsius. Husk at denne verdien ikke endres basert på mengden gull som er til stede, fordi massen allerede er regnskapsført i nevneren til de spesifikke varmeenhetene. Slik er det ikke for varmekapasitet, som du snart vil oppdage.
Varmekapasitet: enkle beregninger
Det overrasker mange studenter ved introduksjonsfysikk at den spesifikke vannvarmen, 4.179, er betydelig høyere enn for vanlige metaller. (I denne artikkelen er alle verdier for spesifikk varme gitt i J / g ° C.) I tillegg er iskapasiteten til is, 2,03, mindre enn halvparten av vanninnholdet, selv om begge består av H2O. Dette viser at tilstanden til en forbindelse, og ikke bare dens molekylære sammensetning, påvirker verdien av dens spesifikke varme.
I alle fall, si at du blir bedt om å bestemme hvor mye varme som kreves for å heve temperaturen på 150 g jern (som har en spesifikk varme, eller S, på 0,450) med 5 C. Hvordan vil du gjøre noe med dette?
Beregningen er veldig enkel; multipliser den spesifikke varmen S med mengden av materialet og temperaturendringen. Siden S = 0,450 J / g ° C, er varmemengden som må tilsettes i J (0,450) (g) (∆T) = (0,450) (150) (5) = 337,5 J. En annen måte å uttrykke dette for å si at varmekapasiteten til 150 g jern er 67,5 J, noe som ikke er mer enn den spesifikke varmen S multiplisert med massen av stoffet som er til stede. Selv om varmekapasiteten til flytende vann er konstant ved en gitt temperatur, vil det selvfølgelig ta mye mer varme å varme en av de store innsjøene med en tidel grad enn det vil ta å varme en halvliter vann med 1 grad , eller 10 eller til og med 50.
Hva er forholdet mellom cp og cv γ?
I en forrige seksjon ble du introdusert for ideen om betingede varmekapasiteter for gasser - det vil si varmekapasitetsverdier som gjelder for et gitt stoff under forhold hvor enten temperaturen (T) eller trykket (P) holdes konstant gjennom hele problemet. Du fikk også de grunnleggende ligningene ∆H = E + P∆V og P∆V = R∆T.
Du kan se fra de to sistnevnte ligningene at en annen måte å uttrykke forandring i entalpi, ∆H, er:
E + R∆T
Selv om det ikke er gitt noen avledning her, er en måte å uttrykke den første loven om termodynamikk, som gjelder for lukkede systemer og som du kanskje har hørt på forhånd sagt at "Energi verken er skapt eller ødelagt,":
∆E = CvAT
På vanlig språk betyr dette at når en viss mengde energi tilsettes et system som inkluderer en gass, og volumet av den gassen ikke får lov til å endre seg (angitt av underskriptet V i Cv), må temperaturen stige i direkte forhold til verdien av varmekapasiteten til den gassen.
Et annet forhold eksisterer blant disse variablene som tillater avledning av varmekapasitet ved konstant trykk, Cp, heller enn konstant volum. Dette forholdet er en annen måte å beskrive entalpi på:
∆H = CpAT
Hvis du er adroit på algebra, kan du komme til et kritisk forhold mellom Cv og Cp:
Cp = Cv + R
Det vil si at varmekapasiteten til en gass ved konstant trykk er større enn dens varmekapasitet ved konstant volum med en eller annen konstant R som er relatert til de spesifikke egenskapene til gassen som blir undersøkt. Dette gir intuitiv mening; hvis du forestiller deg at en gass får utvide seg som svar på økende indre trykk, kan du sannsynligvis oppfatte at den vil måtte varme opp mindre som svar på en gitt tilsetning av energi enn om den var innelukket i samme rom.
Til slutt kan du bruke all denne informasjonen til å definere en annen substansspesifikk variabel, γ, som er forholdet mellom Cp til Cveller Cp/ Cv. Du kan se fra forrige ligning at dette forholdet øker for gasser med høyere verdier av R.
Cp og Cv of Air
Cp og Cv av luft er begge viktige i studiet av væskedynamikk fordi luft (som består av en blanding av for det meste nitrogen og oksygen) er den vanligste gassen som mennesker opplever. Begge Cp og Cv er temperaturavhengige, og ikke nøyaktig i samme grad; som det skjer, Cv stiger litt raskere med økende temperatur. Dette betyr at den "konstante" y faktisk ikke er konstant, men den er overraskende nær en rekke sannsynlige temperaturer. For eksempel, ved 300 grader Kelvin, eller K (tilsvarer 27 C), er verdien av y 1.400; ved en temperatur på 400 K, som er 127 C og betydelig over vannets kokepunkt, er verdien av y 1,395.