Innhold
- Kjennetegn på ikke-metaller
- Kjennetegn på kovalente obligasjoner
- Kovalente elementer
- Vanlige kovalente forbindelser
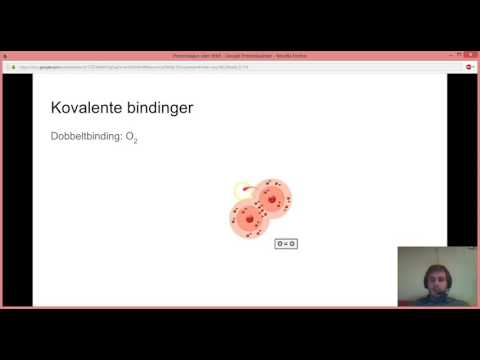
Kovalente bindinger er kjemiske bindinger der to eller flere elementer går sammen ved å dele elektroner, snarere enn å overføre elektroner, som tilfellet er med ioniske bindinger. Disse bindingene har en tendens til å oppstå med ikke-metale elementer i det periodiske systemet. Vann er et kjent stoff som består av hydrogen og oksygen forbundet med kovalente bindinger. Disse elementene anses for å være kovalente. Andre elementer som kan danne kovalente bindinger inkluderer nitrogen, karbon og fluor.
Kjennetegn på ikke-metaller
Den periodiske tabellen er delt inn i to brede grupper: metaller og ikke-metaller. Det er 18 ikke-metaller og mer enn 80 metaller i den periodiske tabellen. Selv om gruppen av ikke-metaller omfatter elementer som har en lang rekke egenskaper, har alle disse elementene visse ting til felles. For eksempel er ikke-metaller dårligere ledere av varme og elektrisitet enn metallelementer. Ikke-metaller er også mindre tette enn metaller og har lavere smelte- og kokepunkt. Det primære kjennetegn ved ikke-metaller som gjør dem kovalente er at de er svært elektronegative, noe som gjør dem mer sannsynlig å danne kovalente bindinger. Ikke-metaller utgjør også det meste av vevet fra levende organismer.
Kjennetegn på kovalente obligasjoner
Fordi ikke-metaller er svært elektronegative, er de mer motvillige til å gi fra seg elektronene sine under bindingsprosessen. Mindre elektronegative metallelementer vil lett gi fra seg elektronene under liming for å skape en stabil forbindelse via ionisk binding. Under ionebinding vil mange metaller gi fra seg elektroner til ikke-metaller. Basert på oktettregelen, som sier at elementer ønsker å ha antall elektroner som den nærmeste stabile edelgass, dannes det forbindelser mellom to sterkt elektronegative ikke-metalliske elementer ved å dele elektronene som ingen av elementene ønsker å gi opp. Fordi kovalente bindinger vanligvis dannes mellom to ikke-metaller, viser disse forbindelsene mange av de samme egenskapene til ikke-metalliske elementer.
Kovalente elementer
De ikke-metale kovalente elementene som finnes i den periodiske tabellen inkluderer hydrogen, karbon, nitrogen, fosfor, oksygen, svovel og selen. I tillegg er alle halogenelementene, inkludert fluor, klor, brom, jod og astatin, alle kovalente ikke-metalliske elementer. De ekstremt stabile edelgassene, inkludert helium, neon, argon, krypton, xenon og radon, er også ikke-metaller kovalente elementer. Disse elementene danner bindinger med hverandre ved å dele elektroner for å danne forbindelser.
Vanlige kovalente forbindelser
Kovalente forbindelser blir navngitt ved å oppgi de første, andre og etterfølgende elementer i forbindelsesformelen, og deretter legge endelsen "-ide" til det endelige elementet. Hvis en forbindelse har mer enn ett elektron per element, legges antall elektroner til i underskrift ved siden av elementet. For eksempel er CF4, eller karbontetrafluorid, en kovalent forbindelse som regnes som en sterk klimagass. Noen av de vanligste forbindelsene som finnes naturlig på jorden, er laget av ikke-metalliske elementer og deres kovalente bindinger. For eksempel er vann, eller H2O, den mest tallrike forbindelsen på jorden og dannes av den kovalente bindingen mellom to hydrogenelektroner og ett oksygenelektron.