Innhold
- TL; DR (for lang; ikke lest)
- En definisjon av aktiveringsenergi
- Eksempler på kjemiske reaksjoner som krever aktiveringsenergi
Mens noen kjemiske reaksjoner starter så snart reaktantene kommer i kontakt, klarer ikke kjemikaliene å reagere før de leveres med en ekstern energikilde som kan gi aktiveringsenergi. Det er flere grunner til at reaktanter i umiddelbar nærhet ikke umiddelbart involverer en kjemisk reaksjon, men det er viktig å vite hvilke typer reaksjoner som krever en aktiveringsenergi, hvor mye energi som kreves og hvilke reaksjoner som fortsetter umiddelbart. Først da kan kjemiske reaksjoner initieres og kontrolleres på en sikker måte.
TL; DR (for lang; ikke lest)
Aktiveringsenergi er energien som kreves for å starte en kjemisk reaksjon. Noen reaksjoner fortsetter umiddelbart når reaktantene er samlet, men for mange andre er det ikke nok å plassere reaktantene i nærheten. Det kreves en ekstern energikilde for å tilføre aktiveringsenergien for at reaksjonen skal fortsette.
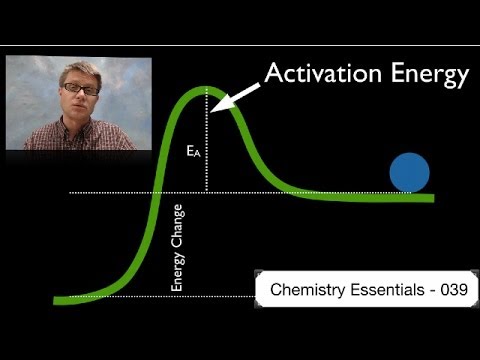
En definisjon av aktiveringsenergi
For å definere aktiveringsenergi må initiering av kjemiske reaksjoner analyseres. Slike reaksjoner oppstår når molekyler utveksler elektron eller når ioner med motsatte ladninger bringes sammen. For at molekyler skal utveksle elektroner, må bindingene som holder elektronene bundet til et molekyl brytes. For ioner har de positivt ladede ionene mistet et elektron. I begge tilfeller er energi nødvendig for å bryte de innledende bindinger.
En ekstern energikilde kan gi energien som kreves for å løsne de aktuelle elektronene og la den kjemiske reaksjonen fortsette. Aktiveringsenergienheter er enheter som kilojoules, kilokalorier eller kilowattimer. Når reaksjonen er i gang, frigjør den energi og er selvopprettholdende. Aktiveringsenergien er bare nødvendig i begynnelsen for å la den kjemiske reaksjonen starte.
Basert på denne analysen er aktiveringsenergi definert som den minste energien som kreves for å starte en kjemisk reaksjon. Når det tilføres energi til reaktanter fra en ekstern kilde, får molekylene fart og kolliderer mer voldsomt. De voldsomme kollisjonene slipper elektroner fri, og de resulterende atomer eller ioner reagerer med hverandre for å frigjøre energi og holde reaksjonen i gang.
Eksempler på kjemiske reaksjoner som krever aktiveringsenergi
Den vanligste reaksjonstypen som krever aktiveringsenergi involverer mange typer brann eller forbrenning. Disse reaksjonene kombinerer oksygen med et materiale som inneholder karbon. Karbonet har eksisterende molekylære bindinger med andre elementer i drivstoffet mens oksygengass eksisterer som to oksygenatomer bundet sammen. Karbon og oksygen reagerer normalt ikke med hverandre fordi de eksisterende molekylære bindinger er for sterke til å bli brutt av vanlige molekylære kollisjoner. Når ekstern energi som en flamme fra en fyrstikk eller en gnist bryter noen av bindingene, reagerer de resulterende oksygen- og karbonatomer for å frigjøre energi og holde en brann i gang til den går tom for drivstoff.
Et annet eksempel er hydrogen og oksygen som danner en eksplosiv blanding. Hvis hydrogen og oksygen blandes sammen ved romtemperatur, skjer det ingenting. Både hydrogen og oksygengass består av molekyler med to atomer bundet sammen. Så snart noen av disse bindingene er brutt, for eksempel av en gnist, resulterer det i en eksplosjon. Gnisten gir noen få molekyler ekstra energi slik at de beveger seg raskere og kolliderer og bryter bindingene. Noen oksygen- og hydrogenatomer kombineres for å danne vannmolekyler og frigjør en stor mengde energi. Denne energien fremskynder flere molekyler, bryter flere bindinger og lar flere atomer reagere, noe som resulterer i eksplosjonen.
Aktiveringsenergi er et nyttig konsept når det gjelder å sette i gang og kontrollere kjemiske reaksjoner. Hvis en reaksjon krever aktiveringsenergi, kan reaktantene lagres sammen trygt, og den tilsvarende reaksjon vil ikke finne sted før aktiveringsenergien tilføres fra en ekstern kilde. For kjemiske reaksjoner som ikke trenger aktiveringsenergi, for eksempel metallisk natrium og vann, må reaktantene oppbevares forsiktig slik at de ikke kommer i kontakt ved et uhell og forårsaker en ukontrollert reaksjon.