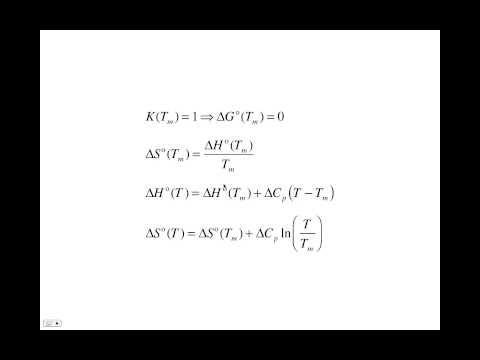
I en kjemisk reaksjon representerer delta H summen av dannelsesvarmene, vanligvis målt i kilojoules per mol (kJ / mol), av produktene minus summen av reaktantene. Bokstaven H i denne formen er lik en termodynamisk mengde kalt entalpi, som representerer det totale varmeinnholdet i et system. Enthalpy, målt i joules (J), er lik systemenes indre energi pluss produktet av trykket og volumet. Det greske bokstavdeltaet ser ut som en trekant og brukes i kjemiske ligninger for å representere endring. Beregning av delta H involverer balansering av reaksjonen, tilsetning av dannelseens varme og å finne forskjellen mellom dannelsen av varmene til produktene og reaktantene. Denne metoden forutsetter konstant trykk i systemet.
Balanser den kjemiske reaksjonen ved å sørge for at du har samme antall atomer av hvert molekyl på reaktanten og produktsidene av ligningen. I et enkelt eksempel der vann og karbon reagerer på å danne karbonmonoksid og hydrogengass, ser den balanserte ligningen slik ut: H2O + C -> CO + H2. Legg merke til at det er samme antall hydrogen, oksygen og karbonatomer på venstre (reaktant) og høyre (produkt) side av ligningen.
Slå opp varmen av dannelse for forbindelsene i ligningen din. Det er varme om dannelsesreferansetabeller i de fleste kjemibøker, og denne informasjonen kan du også finne gjennom et enkelt online søk. Formasjonsvarmen for flytende H2O er –285,83 kJ / mol, og for CO er –110,53 kJ / mol, og formasjonsvarmene for elementene H2 og C er begge 0 kJ / mol. Hvis du har en reaksjon med mer enn ett molekyl av en gitt forbindelse, multipliser varmen av dannelsesverdien med antall molekyler av den aktuelle forbindelsen i reaksjonen din.
Tilsett dannelsesvarmer for reaktantene, H2O + C, som er –285,83 kJ / mol + 0 kJ / mol = –285,83 kJ / mol.
Legg til dannelsesvarmer for produktene, CO + H2, som er –110,53 kJ / mol + 0 kJ / mol = –110,53 kJ / mol.
Trekk summen av dannelsen av reagensene fra produktene for å bestemme delta H: delta H = –110,53 kJ / mol - (–285,83 kJ / mol) = 175,3 kJ.