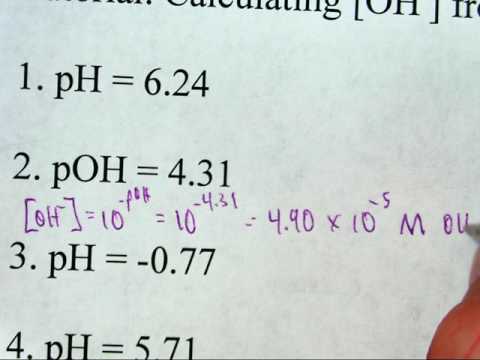
Destillert vann dissosierer svakt og danner hydrogen (H +) og hydroksyd (OH-) -ioner (H2O = H + OH-). Ved en gitt temperatur er produktet av molkonsentrasjoner av disse ionene alltid en konstant: x = konstant verdi. Vannionproduktet forblir det samme konstante antall i en hvilken som helst syre eller basisk løsning. Den logaritmiske pH-skalaen brukes ofte for å uttrykke konsentrasjonen av hydrogenioner. Du kan enkelt og nøyaktig måle pH i løsningen med et instrumentets pH-måler, samt estimere den ved hjelp av kjemiske indikatorer (pH-papir).
Bestem eksperimentelt - for eksempel med en pH-meter - eller få pH-verdien i løsningen andre steder. For eksempel kan pH være 8,3.
Hev "10" til kraften til "-H" ved hjelp av en kalkulator for å bestemme konsentrasjonen av hydrogenionene. I vårt eksempel = 10 ^ (-8,3) eller 5,01 E-9 (notasjonen “E-9” betyr “ti i kraft -9”).
Få vannionproduktet ved den aktuelle temperaturen ved å bruke tabellen gitt i Referanser. Vær oppmerksom på at i de aller fleste beregninger brukes verdien til "1 E-14" tilsvarende en temperatur på 25 Celsius.
Del størrelsesorden "1 E-14" med konsentrasjonen av hydrogenionene for å bestemme konsentrasjonen av hydroksydion. I vårt eksempel = 1 E-14 / 5,01 E-9 = 2,0 E-6 molar.