Innhold
- TL; DR (for lang; ikke lest)
- Betydning av pH og pOH
- Beregning av pH
- Beregning av pOH
- Tilsetting av pH og pOH
Som kjemistudent er en av de grunnleggende ferdighetene du lærer hvordan du beregner pH og pOH for syrer og baser. Konseptene og beregningen er ikke vanskelig hvis du er kjent med logaritmer og konsentrasjonen av løsninger.
TL; DR (for lang; ikke lest)
For å beregne pH = - logg (H3O+ ionkonsentrasjon). Beregning for pOH er - logg (OH- ionkonsentrasjon).
Betydning av pH og pOH
For syrer og baser involverer løsningskonsentrasjonen tall som kan endre seg over et bredt spekter av verdier - over en million til en. I motsetning til de fleste enheter, som er lineære, er pH og pOH begge basert på den vanlige (base 10) logaritmen, slik at du kan uttrykke verdier i ett eller to sifre som ellers vil spenne over mange størrelsesordener. Selv om dette blir vant til, er kompaktheten til pH- og pOH-enheter praktisk og sparer tid og forvirring. PH-enheten indikerer surhet, hvor mindre antall betyr større konsentrasjoner av H3O+ (hydronium) -ioner, og spenner fra over 14 (veldig alkaliske) ned til negative tall (veldig sure; disse negative tallene brukes hovedsakelig til akademiske formål). I denne skalaen har avionisert vann en pH på 7. POH-skalaen er omtrent som pH, men omvendt. Den bruker samme nummereringssystem som pH, men måler OH- ioner. I denne skalaen har vann den samme verdien (7), men du finner baser i den lave enden og syrer i den høye enden.
Beregning av pH
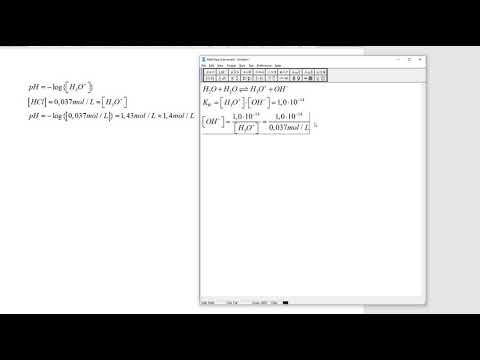
For å beregne pH ut fra den molære konsentrasjonen av en syre, ta den vanlige loggen til H3O+ ionkonsentrasjon, og multipliser deretter med -1: pH = - log (H3O+). For eksempel, hva er pH i en 0,1 M løsning av saltsyre (HCl), forutsatt at syren er fullstendig demontert i ioner i løsningen? Konsentrasjonen av H3O+ ioner er 0,1 mol per liter. pH = - log (.1) = - (- 1) = 1.
Beregning av pOH
Beregningen for pOH følger de samme reglene som for pH, men bruker konsentrasjonen av OH- ioner: pOH = - logg (OH-). Finn for eksempel pOH til en 0,02 M løsning av natriumhydroksyd (KOH). Konsentrasjonen av OH- ioner er 0,02 mol per liter. pOH = - log (0,02) = - (- 1,7) = 1,7.
Tilsetting av pH og pOH
Når du beregner både pH og pOH for en gitt løsning, legger antallet alltid opp til 14. For eksempel er pH og pOH for vann 7, og 7 + 7 = 14. 0,02 M-oppløsningen av natriumhydroksyd i eksempelet ovenfor vil ha en pH på 12,3. Dette betyr at hvis du vet pH, kan du trekke den fra 14 for å finne pOH, og omvendt.