Atomer består av en tett kjerne, eller kjerne, som inneholder positivt ladede partikler kalt protoner og uladede partikler kalt nøytroner. Negativt ladede elektroner opptar noe avgrensede områder av rommet utenfor kjernen som kalles orbitaler. Protoner og nøytroner veier nesten 2000 ganger mer enn elektroner og representerer derfor nesten all atommassen. For ethvert gitt element i den periodiske tabellen er antallet protoner i atomene i atomene. Hvert karbonatom, for eksempel, inneholder seks elektroner. Antall elektroner samsvarer med antall protoner i et nøytralt atom, men atomer kan få eller miste elektroner under kjemiske reaksjoner. Antall nøytroner varierer også fra et atom til det neste. Kjemikere refererer til atomer av samme element med forskjellige antall nøytroner som isotoper. Å forstå disse begrepene representerer nøkkelen til å bestemme protoner, nøytroner og elektroner i en isotop.
Identifiser massenummeret til isotopen fra dets symbol. Etter stevne oppgir forskere massetallet til en isotop som et påstående nummer foran elementets symbol, for eksempel 235U, eller med bindestrek etter symbolet, som i U-235.
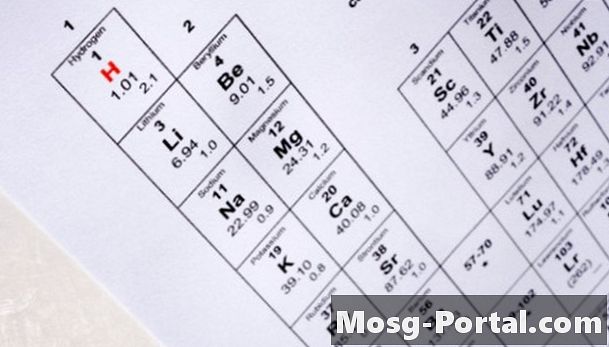
Bestem antallet protoner i isotopens kjernen ved å plassere atomnummeret på det periodiske systemet for elementene. Den periodiske tabellen ordner elementer ved å øke atomantallet. U representerer for eksempel det kjemiske symbolet for uran og det har et atomnummer på 92. Dette betyr at alle uranatomer inneholder 92 protoner i kjernen.
Beregn antall elektroner som isotopen inneholder ved å merke seg om symbolet inkluderer en ladning. Ladningsnotasjonen representerer enten et positivt eller negativt tall, vanligvis skrevet som et påskrift etter det kjemiske symbolet, for eksempel 235U (4+). Dette indikerer at uranatom har mistet fire elektroner. I mangel av en oppgitt ladning, har isotopen en ladning på null, og antallet elektroner tilsvarer antallet protoner. Trekk positive ladninger fra eller legg negative ladninger til atomnummeret hvis symbolet inneholder en angitt ladning. 235U (4+) vil for eksempel inneholde 92 - 4 = 88 elektroner.
Finn antall nøytroner i isotopen ved å trekke antall protoner fra massetallet som er gitt i symbolet. For eksempel inneholder 235U, som inneholder 92 protoner, 235 - 92 = 143 nøytroner.