Innhold
- Periodisk organisering
- Vitenskapelig begrunnelse
- Alkali og jordalkalimetaller
- Overgangsmetaller
- Metalloider og ikke-metaller
- Edelgasser
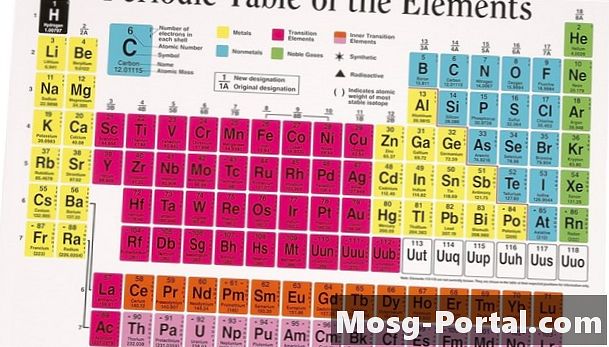
Den periodiske tabellen, som inneholder alle de naturlig forekommende og galne kjemiske elementene, er den sentrale søylen i ethvert kjemiklasserom. Denne klassifiseringsmetoden stammer fra en bok fra 1869, skrevet av Dmitri Ivanovich Mendeleev. Den russiske forskeren la merke til at da han skrev de kjente elementene i rekkefølge for å øke atomvekten, han lett kunne sortere dem i rader basert på lignende egenskaper. Utrolig nok var likhetene så særegne at Mendeleev var i stand til å forlate mellomrom for flere uoppdagede elementer i sin periodiske klassifisering.
Periodisk organisering
I den periodiske tabellen er et element definert av den vertikale gruppen og den horisontale perioden. Hver periode, nummerert en til syv, inneholder elementer med økende atomnummer.I motsetning til Mendeleevs opprinnelige liste, er den moderne periodiske tabellen basert på atomnummer, eller antall protoner i en atomkjerneelement. Protonnummeret er et logisk valg for organisering av elementene, siden protoner bestemmer den kjemiske identiteten til et atom, mens atomvekten varierer med forskjellige atomisotoper. Atten kolonner er i den periodiske tabellen, vanligvis referert til som grupper. Hver gruppe inneholder flere elementer som har lignende fysiske egenskaper på grunn av deres underliggende atomstruktur.
Vitenskapelig begrunnelse
Atomet er den minste delingen av materie som opprettholder sin identitet som et kjemisk element; den er av en sentral kjerne omgitt av en elektronsky. Kjernen har en positiv ladning på grunn av protonene, som tiltrekker seg de små, negativt ladede elektronene. Elektronene og protonene er like i antall for et nøytralt atom. Elektronene er organisert i orbitaler eller skjell på grunn av kvantemekanikkens prinsipper, som begrenser antall elektroner i hvert skall. Kjemiske interaksjoner mellom atomer påvirker vanligvis bare de ytre elektronene i det siste skallet, kalt valenselektronene. Elementene i hver gruppe har samme antall valenselektroner, noe som får dem til å reagere på samme måte når de får eller mister elektroner til andre atomer. Elektronskjellene øker i størrelse, forårsaker den økende periodestørrelsen på det periodiske systemet.
Alkali og jordalkalimetaller
Helt til venstre i den periodiske tabellen inkluderer to grupper av høye reaktive metaller. Med unntak av hydrogen består den første kolonnen av de myke, blanke alkalimetallene. Disse metallene har bare ett elektron i valensskallet, som lett kan gis til et annet atom i kjemiske reaksjoner. På grunn av deres eksplosive reaktivitet i både luft og vann, finnes sjelden alkalimetallene i deres grunnleggende form i naturen. I den andre gruppen har jordalkalimetallene to valenselektroner, noe som gjør dem litt hardere og mindre reaktive. Imidlertid finnes disse metallene fortsatt sjelden i sin elementære form.
Overgangsmetaller
De fleste elementene i den periodiske tabellen er klassifisert som metaller. Overgangsmetallene ligger i midten av bordet og spenner over grupper tre til 12. Disse elementene er faste ved romtemperatur, unntatt kvikksølv, og har den metalliske fargen og formbarheten som forventes av metaller. Fordi valensskallene blir så store, blir noen av overgangsmetallene trukket ut fra det periodiske systemet og lagt til bunnen av diagrammet; disse kjent som lantanidene og aktinidene. Mange av overgangsmetallene nær bunnen av det periodiske systemet er sjeldne og ustabile.
Metalloider og ikke-metaller
På høyre side av det periodiske systemet deler en grov diagonal linje metallene til venstre fra ikke-metallene til høyre. På denne linjen er metalloidene, som germanium og arsen, som har noen metalliske egenskaper. Kjemikere kategoriserer alle elementer til høyre for denne skillelinjen som ikke-metaller, med unntak av gruppe 18 helt til høyre. Mange av ikke-metallene er gassformige, og alle er bemerkelsesverdige for deres tendens til å skaffe elektroner og fylle valensskallene.
Edelgasser
Gruppe 18, helt til høyre på det periodiske systemet, består utelukkende av gasser. Disse elementene har full valensskall, og har en tendens til verken å få eller miste elektroner. Som et resultat eksisterer disse gassene nesten utelukkende i sin elementære form. Kjemikere klassifiserer dem som edle eller inerte gasser. Alle edle gasser er fargeløse, luktfrie og ikke-reaktive.