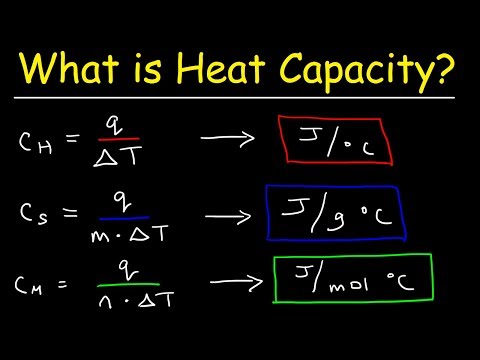
Den molære varmekapasiteten til et stoff er mengden energi som kreves for å heve en mol av stoffet med en grad. Standardenheten er joules per mol K. En periodisk tabell viser vanligvis den spesifikke varmekapasiteten til et element. Spesifikk varme skiller seg fra molær varmekapasitet ved at den måles per gram i stedet for per mol. Avhengig av informasjonen du har og stoffet det er snakk om, kan det å beregne den molære varmekapasiteten til et stoff være en enkel konvertering eller en mer involvert beregning.
Bestem stoffets spesifikke varme. Hvis stoffet er laget av et enkelt element, er den spesifikke varmen oppført i mange periodiske tabeller. For eksempel er den spesifikke sølvvarmen omtrent 0,23 J / g * K. Hvis stoffet er en forbindelse av flere elementer, må du verifisere den spesifikke varmen enten eksperimentelt eller fra et allerede eksisterende dokument (se Ressurser for en tabell med vanlige spesifikke varmer).
Beregn stoffets molmasse. Den periodiske tabellen viser molmassen til hvert element. Hvis det er en forbindelse, må den molære massen beregnes gjennom forholdstall. For eksempel involverer en mol vann 2 deler hydrogen og 1 del oksygen. Den molære massen av vann oppnås ved å multiplisere hver av disse delene med de tilsvarende massene av elementene:
2 x (1 g / mol hydrogen) + (16 g / mol oksygen) = 18 g / mol vann
Multipliser stoffets spesifikke varme med stoffets molmasse. Dette resulterer i stoffets molære varmekapasitet, i joules per mol K. For vann er for eksempel den spesifikke varmen gitt som omtrent 4,144 J / (g * K). Multipliser dette med molmassen:
4,184 x 18 = 75,312 J / (mol * K)