
Innhold
- TL; DR (for lang; ikke lest)
- Hvordan beregne føflekker
- Konvertering til Mmol
- Løsningskonsentrasjon
- Eksempel
For bare å beregne, opprettet kjemikere en standardenhet for antall atomer av en bestemt forbindelse involvert i en reaksjon eller en annen kjemisk prosess. De definerer en mol (mol) som mengden av et hvilket som helst stoff som har samme antall grunnleggende enheter som 12 gram karbon-12, som er Avogadros-nummer (6.022 × 1023). SI (metrisk) målesystem definerer en millimol (Mmol) som en promille. Du beregner vanligvis antall mol av et stoff ved å veie mengden du har for hånden. Hvis du vil konvertere til Mmol, multipliser med 103 (1,000).
TL; DR (for lang; ikke lest)
En mol er lik Avogadros antall partikler av en bestemt forbindelse. En millimol (Mmol) er en promille.
Hvordan beregne føflekker
Atommasser måles i atommassenheter (AMU). En AMU er nøyaktig 1/12 massen til kjernen til et karbon-12 atom i dens grunntilstand. En mol av et stoff er definert å være lik Avogadros antall partikler av det stoffet. I henhold til denne definisjonen er vekten til en mol av et stoff i gram det samme tallet som vekten til en individuell partikkel av det stoffet i AMU. For eksempel er atomvekten til karbon-12 12 AMU, så en mol karbon-12 veier 12 gram.
Tenk på en beholder full av hydrogengass (H2). Hver partikkel i beholderen er et molekyl som består av to hydrogenatomer, så du trenger bare å kjenne atommassen til hydrogen for å beregne molekylvekten. De fleste versjoner av den periodiske tabellen viser atommassen til hvert element under dets symbol. For hydrogen, som har et enkelt proton i kjernen, er det 1.008 AMU, som er et gjennomsnitt av alle de naturlig forekommende isotoper av hydrogen. Følgelig er atommassen til hydrogengass 2,016 AMU, og en mol hydrogengass veier 2,016 gram. For å finne antall mol i prøven din, ville du veie prøven i gram og dele den vekten med molekylvekten til hydrogengass i gram. For eksempel inneholder en prøve som veier 15 gram ren hydrogengass 7,44 mol.
Konvertering til Mmol
Noen ganger er mengder som er undersøkt så små at det å uttrykke dem i føflekker er tungvint. Gå inn i millimolen. Ved å multiplisere antall føflekker med tusen, kan du konvertere et veldig lite antall til et mer håndterbart. Dette er spesielt praktisk når du arbeider med volumenheter i størrelsesorden milliliter.
1 mol = 1000 Mmol
Løsningskonsentrasjon
Kjemikere bruker molaritet som et mål på konsentrasjon av en bestemt forbindelse i oppløsning. De definerer molaritet som antall føflekker per liter. Du konverterer molaritet til millimolaritet ved å multiplisere med 1000. For eksempel har en 1 mol (molar, også skrevet som M) løsning en konsentrasjon på 1 mol per liter. Dette tilsvarer en 1000 Mmol (millimolar, også noen ganger skrevet som mM), som er en som inneholder 1 000 Mmol per liter.
Eksempel
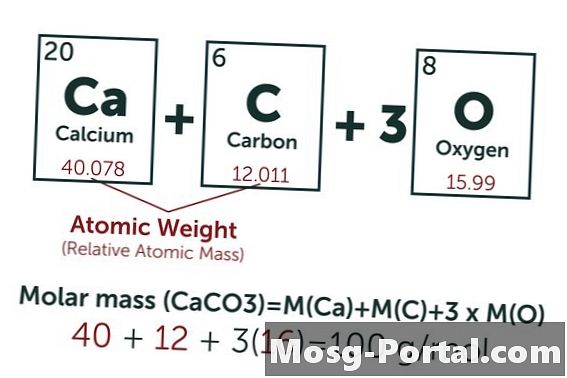
En løsning inneholder 0,15 gram kalsiumkarbonat. Hvor mange millimol er det?
Den kjemiske formelen for kalsiumkarbonat er CaCO3. Atomvekten til karbon (C) er omtrent 12 AMU, oksygen (O) omtrent 16 AMU og kalsium (Ca) ca. 40 AMU. Hvert molekyl kalsiumkarbonat veier dermed 100 AMU, noe som betyr at en mol veier omtrent 100 gram. En vekt på 0,15 gram representerer 0,15 g ÷ 100 g / mol = 0,0015 mol. Dette tilsvarer 1,5 Mmol.
Hva er molariteten og millimolariteten til dette mye kalsiumkarbonatet i 2,5 liter løsning?
Molaritet er definert som antall mol per liter, så del antall mol med 2,5 for å få molariteten: 0,0015 ÷ 2,5 =
0,0006 M
Multipliser med 1000 for å få millimolaritet =
0,6 mM
Merk at du kommer til samme resultat for millimolaritet hvis du deler antall millimol med volumet av løsningen.